在深入探讨新版GMP对水处理过滤器滤芯除菌工艺要求与验证的过程中,我们首先需要明确,非最终灭菌产品的过滤除菌必须遵守一系列严格的标准。第七十五条规定了这一领域内的一系列重要原则,其中尤其强调,任何可最终灭菌的药品都不得将其生产过程中的过滤除菌作为替代最终灭菌步骤。然而,如果由于某些特殊原因,这些药品在它们最终包装容器中无法进行有效灭菌,那么可以通过0.22微米或更小、相同或更高效率的除菌过滤器,将药液分配至预先被彻底消毒的容器中。
尽管如此,由于这些过滤设备无法完全排除病毒和其他微生物,因此我们必须采取额外措施来补充这种不完美的过滤效果。这通常涉及采用热处理技术来增强整个过程中的安全性。此外,为了降低风险,我们应该安装至少两套已经经过消毒并且功能正常的相似型号(如果可能的话)的第二个已消毒过滫再次筛选药物,以确保最后一次使用时是从接近灌装点的地方开始。
当使用这些设备后,他们必须立即接受适当检查,并记录结果。常用的方法包括起泡测试、扩散试验以及压力保持测试等以评估其完整性。在实施前,该设备还需要通过验证程序,以确定所需时间以及两端产生的大气压力。当检测到任何异常情况,如超出正常范围内所需时间或压力的变化,都应详细记录并进行调查,最终结果将纳入批量生产记录之中。

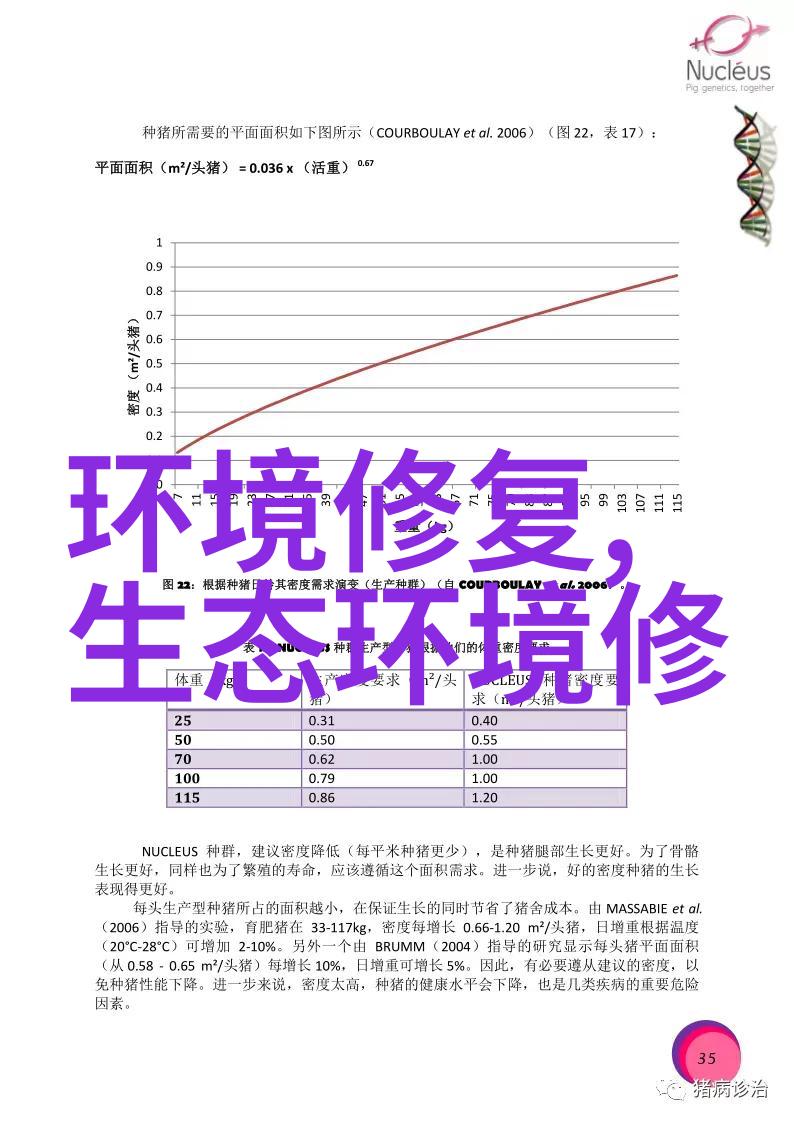
此外,对于同一规格和型号的人员护理用水处理材料,其有效期限也必须经过验证,并且通常不会超过工作日的一天。图一展示了生物制剂行业中的典型筛选流程;图二则展示了一种用于输液治疗的小孔大小分离技术(LVPSVP);而图三则为API原料药分离示例,展现了不同规模和类型实验室操作环境下的应用场景。
综上所述,这篇文章深入分析了新版GMP对于水处理材料在执行除了去芥末作用以外还有杀死微生物作用方面提出的严格要求,以及如何通过科学验证来确保整个工程能够达到最佳状态,从而保障医疗用品质量,为患者提供安全可靠的治疗方案。